「レプトスピラ」細菌の運動の仕組みを解明
- レプトスピラ感染症の発症機構の解明に役立つと期待 -
2018/05/31
【発表のポイント】
・「レプトスピラ(1)」という細菌は、らせん形の菌体を“ネジ”のように回して水中を泳ぎ、固体表面に貼りつくと“ドリル戦車”のように這いまわります。
・本研究では、レプトスピラの「水陸両用」ともいえる運動の仕組みを明らかにし、2種類の運動をスムーズに切り替える機構のモデルを提案しました。
・レプトスピラは、野生動物、家畜、ペットの腎臓に棲みつき、人に感染すると黄疸や腎不全などを引き起こします。本成果は本症の発症メカニズムの解明、予防法の開発につながると期待されます。
【概要】
東北大学の田原孟氏(当時・大学院生)と中村修一助教らは、国立感染症研究所、大阪大学などと共同で、光学顕微鏡を用いた詳しい細胞運動解析により、「レプトスピラ」という運動性細菌の菌体表面における分子の動きなどを定量的に解析することに成功しました。その結果、接着性の分子が菌体表面を自由に動き回ることにより、スイミング(遊泳モード)からクロウリング(這い回りモード)へのスムーズな切り替えを可能にしていることが分かりました。
レプトスピラは、動物の皮膚から体内に侵入し、血流にのって全身に広がったあと、腎臓に棲みつきます。この研究の結果は、「動物内に侵入してから特定臓器に達するまではスイミングが、臓器接着後の移動にはクロウリングが使われる」という感染機構モデルを提案するもので、レプトスピラ感染症の発症機構の解明に役立つと期待されます。レプトスピラが属する「スピロヘータ」という細菌グループには、近年感染報告が急増している梅毒の原因菌(トレポネマ)など、人や動物の健康にとって重要な種が多く含まれます。これらは細胞構造や運動性に類似点が多いことから、本研究の成果は、他のスピロヘータ感染症の研究にも役立つものと思われます。
この成果は、2018年5月31日 午前4時(日本時間)公開の米国AAASが発行するScience Advances誌(オンライン)で公開されます。
※ 顕微鏡観察動画、光学顕微鏡写真、電子顕微鏡写真が多数あります。
【研究内容の詳細】
1.研究の背景
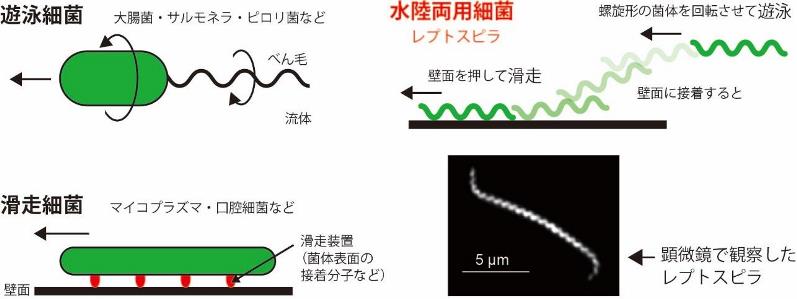
細菌は大きさ数マイクロメートルの微生物です。細菌の仲間には、運動性を持つものが多く知られていますが、運動の様式は実に多様です(図 1)。例えば、大腸菌やサルモネラは、菌体の外側に向かって伸びる繊維状の器官(べん毛(2) )を使って水中を泳ぎます。肺炎を引き起こすマイコプラズマや口腔細菌の仲間は、固体表面を滑るように這い回ります。多くの細菌は1種類の運動機構を備えますが、「レプトスピラ」という細菌は、水中で泳ぐだけでなく、固体面上に貼りついてもなお動くことができる「水陸 両用」的な2種類の運動性を持つことが知られています。
レプトスピラは、「スピロヘータ」というらせん形細菌の仲間で、右巻きらせん状の菌体を持ちます。べん毛は2本ありますが、大腸菌のように菌体の外側に伸びておらず、菌体の“内部”に生えています。大腸菌のべん毛はスクリュープロペラのようなものですが、レプトスピラのべん毛は、菌体の内側から、菌体そのものを回すことによって推力を生み出します。レプトスピラの水陸両用運動は 1974 年のNature誌でCoxとTwiggによって初めて報告され、遊泳“スイミング”に対して、固体表面を這いずり回る運動は“クロウリング”(crawling: 芋虫の動きなどに使われる表現)と称されました。レプトスピラは、人も含む様々な哺乳動物に感染して腎不全などを引き起こす人獣共通感染症「レプトスピラ症」の病原体です。この病気は、全世界的に流行が見られ、国内でも河川のレジャーなどが原因と思われるアウトブレイクが報告されています(2016 年 9 月沖縄など)。運動性を失ったレプトスピラの感染力は著しく低下することから、運動性は必須の病原因子である言われています。しかし、レプトスピラの菌体は一般的な顕微鏡では見えないほど極細(大腸菌の 1/10 程度)であることなどから、菌体の回転や菌体表面の動態を詳しく調べることは難しく、動くメカニズムも、運動性が具体的にどのように感染に寄与するかも、ほとんど分かっていませんでした。
2.本研究の成果
東北大学の田原孟氏(当時・大学院生)を中心とする中村修一助教の研究チームは、国立感染症研究所(感染研)の小泉信夫主任研究官、大阪大学(阪大)の川本晃大特任助教らと共同で、観察対象を強く散乱させることにより高コントラストな像を得る暗視野照明法(3)や、蛍光色素やマイクロビーズを介して菌体表面の動態を可視化する一分子計測技術(4)によって、レプトスピラの2種類の運動を詳細に解析し、その仕組みを明らかにしました。
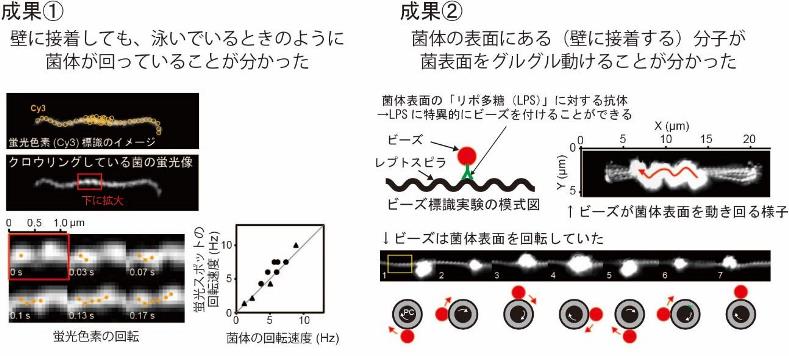
「固体面に貼り付いているのに、なぜ動けるのか」という最も重要な問いに答えるため、ガラス面に接着している菌体の表面に蛍光色素を結合させることによって、接着中の菌の動きを調べました。その結果、固体面に接着してもなお、らせん形菌体は遊泳中と同程度の速度で回転していることが分かりました(図2成果①)。レプトスピラは接着点(接着分子)を“足場”にしてクロウリングしていることが予想されましたが、そのためには、接着分子は菌体表面のある場所に固定されず、自由に動けなくてはなりません。
菌を壁面上に接着させるための“アンカー(いかり)”の役割をして、なおかつクロウリングのための“足場”ともなり得る菌体表面分子の候補として、レプトスピラの菌体表面に豊富にあるリポ多糖(LPS)に注目しました。LPSは様々な細菌(主にグラム陰性細菌)が持つ外膜成分です。LPSの構造は同種でも株によって異なり、レプトスピラの場合は、LPSの違いによって250種類以上もの株(血清型)に分類されます。血清型によって感染できる動物が異なる場合もあるので、LPSは病気の発症機構に関わる重要分子と考えられています。LPSに特異的に反応する抗体(5)を介してポリスチレン製ビーズ(直径約200nm)を付着させたところ、水中で遊泳している菌の表面を、ビーズがグルグルと旋回する様子が観察されました(図2成果②)。
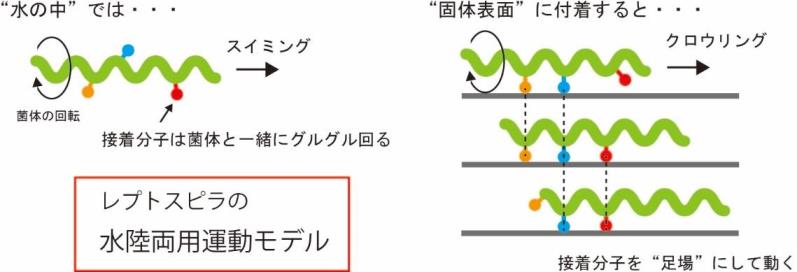
以上の結果を踏まえて、スイミング-クロウリング切り替えモデルを提案しました(図3)。スイミングのための推進力は、らせん菌体の回転で与えられます。スイミング中も接着分子はグルグルと菌体表面を動いていると思われますが、推進力発生には寄与しません。接着分子を介して固体面に付着しても、菌体らせんの回転は持続され、接着点を足場にしたクロウリングが起こります。接着には様々な外膜成分が関わると思われますが、本研究は、LPSがその1つである可能性を示しました。
3.研究成果の意義・将来展望
レプトスピラは、動物の皮膚から体内に侵入し、血流にのって全身に広がったあと、腎臓に棲みつきます。この研究の結果は、「動物内に侵入してから特定臓器に達するまではスイミングが、臓器接着後の移動にはクロウリングが使われる」という感染機構モデルを提案するもので、レプトスピラ感染症の発症機構の解明に役立つと期待されます。レプトスピラが属する「スピロヘータ」という細菌グループには、近年感染報告が急増している梅毒の原因菌(トレポネマ)など、人や動物の健康にとって重要な種が多く含まれます。これらは細胞構造や運動性に類似点が多いことから、本研究の成果は、他のスピロヘータ感染症の研究にも役立つものと思われます。
本研究は、科学研究費補助金・新学術領域「運動超分子マシナリーが織りなす調和と多様性」の支援(15H01307)により行われました。
【用語解説】
(1) レプトスピラ
細菌の一種。正確には、分類学上の属名(レプトスピラ属)。らせん形の細長い菌体の内部にべん毛が生えている。レプトスピラ属には、レプトスピラ症を引き起こす病原性種と、病原性のない種が含まれる。レプトスピラ症については、「研究内容の詳細・研究の背景」を参照。
(2) べん毛
細菌の主要な運動器官。大腸菌やサルモネラでは、菌体の表面から生える繊維状の構造体として観察される。べん毛は、繊維の根元(細胞膜中)に存在する「べん毛モーター」と呼ばれる蛋白質複合体によってスクリュープロペラのように回され、推進力を生み出す。べん毛の本数や生えている場所は、種によって異なる。
(3) 暗視野照明法
生物試料の観察で基本的によく使われるのは、試料を均一に照明して、試料を透過してきた光を観察する「明視野照明法」である。この方法では、観察できるサイズが、観察に使用する光の波長の半分程度に限られる(波長 550nmくらいの緑色の光を使う場合、200nmくらいが限界)。暗視野照明法は、試料に斜めから強い光をあてることで対物レンズに照明光が直接入るのを防ぎ、“暗い背景”の中で試料の散乱光を観察する手法。夜空に星が光るのと同じように、明視野照明では見られないほど小さい物体(数十ナノメートル)も、高いコントラストで観察することができる。
(4) 一分子計測技術
細胞の中で動く蛋白質など、観察対象が小さすぎる、多数の分子が一度に動き回っていて複雑である、といったように、“生”のままでは観察が難しい状況がある。そのようなとき、調べたい分子に“目印”を付けることで特定分子の動きや反応に注目する技術が、一分子計測技術である。目印としては、蛍光色素やマイクロビーズなどが主に使われる。これまでに、筋肉のエネルギー変換機構や、DNA の複製過程など、様々な現象の解明に役立ってきた。
【論文情報】
H. Tahara, K. Takabe, Y. Sasaki, K. Kasuga, A. Kawamoto, N. Koizumi, S. Nakamura,
The mechanism of two-phase motility in the spirochete Leptospira: Swimming and crawling. Science Advances 4, eaar7975 (2018).