探針型の顕微鏡でチップ内の血管機能を可視化
~生体模倣システムの新たな計測法を開発~
2021/08/20
発表のポイント
- 新たな細胞培養法として、微小流体デバイスを用いた生体模倣システム(MPS)が注目されている。しかし、MPSのセンシングシステムの開発は十分に進んでいなかった。
- 本研究グループは、血管のMPSをモデルとして、探針型の顕微鏡(走査型プローブ顕微鏡)を用いた新たなMPSの評価系を検証し、報告した。
- 今回示した解析手法を、様々なMPS(肺、神経など)へ展開することで、従来取得できなかった細胞の機能に関するデータが取得可能であると期待される。
概要
微小な流体デバイス内で、ヒトの組織構造を再構築する試みが盛んです。生体模倣システム(Microphysiological system,MPS)、またはorgan-on-a-chipと呼ばれるこの手法では、ヒト体内の細胞応答も高精度な評価が可能です。しかし多くの研究は、「組織構造をどのように模倣するか」に注力しており、構築したMPSを評価するためのセンシングシステムの開発は遅れていました。
東北大学学際科学フロンティア研究所の梨本裕司助教、大学院工学研究科の珠玖仁教授、大学院環境科学研究科の阿部充里さん(元大学院生)、藤井遼太さん(元大学院生)らの研究グループは、金沢大学ナノ生命科学研究所の高橋康史教授、スペインのInstitute for Bioengineering of CataloniaのJavier Ramon Azon教授らと共同で、走査型プローブ顕微鏡の1種である、走査型電気化学顕微鏡(SECM)、走査型イオンコンダクタンス顕微鏡(SICM)を用い、MPS内に構築した血管モデルの細胞機能の透過性や形状を取得するセンシング法の開発に成功しました。本研究成果は、生体医工学分野の国際的な学術誌である『Advanced Healthcare Materials』にて、2021年8月20日(日本時間)に掲載されました。
研究の背景
薬剤の開発では、培養皿を用いた細胞に対する初期スクリーニング、動物実験を経て臨床試験に至るまで、多くの時間的、金銭的なコストがかかります。この薬剤開発の効率を向上させるため、近年、微小な流体デバイス内で細胞培養を行う、生体模倣システム(MPS)と呼ばれるシステムが注目を集めています。MPSでは、複数の細胞種、細胞の足場となるマトリクスを精緻に配置し、さらに体内の血流や運動といった力学負荷を再現することで、従来の培養手法では困難であった、生体内に近い細胞機能を引き出すことができます[1]。
多くのMPSの研究は、「どのように組織構造を模倣するか」に注力しており、MPSを評価するためのセンシングシステムの開発は立ち遅れていました。MPSの細胞の観察、機能評価は、第一には光学顕微鏡による観察が行われます。しかし、MPSはシステムの複雑性から、測定対象と対物レンズからの距離が一般的な培養容器よりも遠く、高い解像度での観察が困難です。
一方、MPSに組み込むための電気化学センサは細胞機能をリアルタイムにモニタする、期待の大きな手法です。しかし、従来のセンサは多くの場合に一つにつき一つのMPSしか備えられておらず、光学顕微鏡のように、MPS内の空間的な細胞機能の分布を知ることはできませんでした。
研究グループではこれまで、光学システムによらない、電気化学イメージングシステムの開発を進めてきました[2]。そこで本研究では、電気化学イメージングシステムの一つである、走査型プローブ顕微鏡をMPSの評価システムとして利用することを着想し、血管のMPSを対象として、SPMを利用した細胞機能評価法の開発を検討しました。
本研究の内容
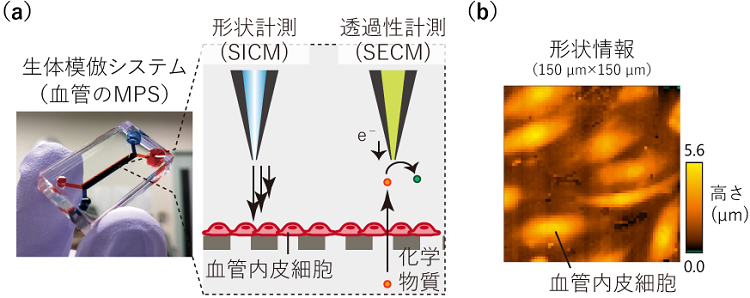
本研究では、走査型プローブ顕微鏡の中でも、微細な形状情報を取得可能な走査型イオンコンダクタンス顕微鏡(SICM)と走査型電気化学顕微鏡(SECM)を用いました。評価対象としては、血管のMPSを採用しました。このMPSでは、微小な流路を積層し、一方に血管内皮細胞を敷き詰めることで、血管内と血管外の組織の界面を再現しています。MPSの天面に微小な穴(直径0.5 mm)を設け、SICM、SECMの探針を挿入し、電気化学イメージングを行うための挿入口としました(図1(a))。
SECMを用いた細胞機能評価では、血管モデルを通過する化学物質(電気化学トレーサー)の透過量を定量的に解析し、血管の透過性を算出することに成功しました。また細胞がある状態ではシグナルが非常に微弱ではありましたが、SECMの探針である微小電極をデバイスの中で走査することで、物質の透過性の部位特異性を検出可能でした。また、SICMを用いた形状評価では、血管の内面の形状を精細に観察可能であることを確認しました(図1(b))。血管は、流れの負荷に応じて、その表面形状が変化することが知られていますが、構築した血管のMPS内に、流れを付与した際には、血管内の凹凸が小さくなる現象が観察されました。
最後に、本評価を、腸の血管モデルに適用し、評価を試みました。装置の稼働範囲の限界から、形態情報の詳細な評価は困難でしたが、腸の上皮細胞と血管内皮細胞が積層することで、物質の透過性が非常に小さくなっており、さらに流れの付与により、モデルの堅牢性が高まる可能性が示唆されました。
以上のことは、血管の透過性や形態情報といった、血管のMPSの基本的な機能評価に、走査型プローブ顕微鏡が有効であることを示しています。
今後の展望
本研究では、血管の透過性、形態情報といった基本的な機能評価項目に関して、走査型プローブ顕微鏡の有効性を示しました。走査型プローブ顕微鏡は、神経細胞からの神経伝達物質の放出、幹細胞の分化、さらに、細胞上で非常に微細な微絨毛の評価に有効であることを研究グループは既に示しています。今回示した解析手法を、様々なMPS(肺、神経など)へ展開することで、従来取得できなかったような細胞の機能に関するデータが取得可能であると期待されます。
さらに、研究グループが開発している他の電気化学イメージングツール(Bio-LSI[3]、バイポーラー電気化学顕微鏡[4]、電気化学発光システム[5])とMPSを組みわせることで、さらに多様なMPSの評価ツールが開発されるものと期待されます。
本研究は、SDGsの目標のうち、「3. すべての人に健康と福祉を」、「9. 産業と技術革新の基盤をつくろう」に関するものです。
研究プロジェクトについて
本研究は、主に日本学術振興会科学研究費補助金(課題番号18H01999,18H01840,19K20658,21H01957,21H03803,20J11174)、科学技術振興機構センター・オブ・イノベーション(COI,課題番号JPMJCE1303)、中谷医工計測技術振興財団、インテリジェント・コスモス学術振興財団、文部科学省世界で活躍できる研究者戦略育成事業「学際融合グローバル研究者育成東北イニシアティブ(TI-FRIS)」の支援を受けて行われたものです。
論文情報
著者: 梨本裕司*,阿部充里†,藤井遼太†,平典子,井田大貴,高橋康史,伊野浩介,Javier Ramon Azcon,珠玖仁* (*責任著者,†同程度に本論文に貢献)
掲載誌: Advanced Healthcare Materials(DOI: 10.1002/adhm.202101186)