複数のマイクロRNAを同時検出する「RNA液滴コンピュータ」の開発に成功
- 細胞の中で働く微小ロボットや化学的人工知能の実現にも貢献 -
2024/06/07
発表のポイント
- 分子を選択的に感知する機能をプログラムした、論理演算を実行するRNA液滴を作製
- 2つの特定のRNAが入力された場合のみ液滴が溶解する挙動を利用することで、がんのバイオマーカーとして知られるマイクロRNAの検出に成功
- 生体や生細胞の中で、病気の診断、薬物送達、機械的動作などを行うインテリジェントな微小ロボットや化学的な人工知能を実現する技術への貢献
概要
東京工業大学 情報理工学院 情報工学系の瀧ノ上正浩教授、鵜殿寛岳博士研究員(学術振興会特別研究員)、范敏之大学院生(研究当時)、齊藤洋子技術員(研究当時)、京都大学iPS細胞研究所の齊藤博英教授、大野博久助教、東北大学大学院工学研究科 ロボティクス専攻の野村M.慎一郎准教授、理化学研究所生命機能科学研究センターの清水義宏チームリーダーらの研究グループは、がんのバイオマーカーである特定のマイクロRNA(miRNA)(注1)を選択的に認識し、AND演算(注2)の結果を出力できる「RNA液滴コンピュータ」の開発に成功した。
細胞内部では、生体分子が自発的に集合して微小な液体状の構造物(液滴)が形成される。この液–液相分離(注3)と呼ばれる現象は、細胞の構造と機能の制御、さらには病気に深く関与している。近年では、プログラマブルな生体分子(注4)であるDNAが形成するDNA液滴の研究が進展している。もう一つのプログラマブルな分子であるRNAの液滴が機能性を備えることは報告されていなかった。そこで、本研究では、ターゲットとする2種類のmiRNAが入力されたときだけAND演算を実行して液滴を溶解するようにプログラムしたRNA液滴を構築し、さらにその挙動を実証することに成功した。本研究で実現されたRNA液滴コンピュータは、がん診断、薬物送達などの医薬分野への応用が見込まれる。
本研究では人工的に合成されたRNAを用いたが、将来的にはRNA液滴の設計図をコードしたDNAの鋳型を生細胞や人工細胞の中に導入し、細胞内の転写(注5)機構を利用して遺伝子を発現させることも可能となる。本研究成果は、細胞の中で自律的に駆動するインテリジェントな微小ロボットや人工知能デバイスの実現に向けた重要な足がかりとなる。
本研究成果は、2024年6月3日(現地時間)に米国化学会刊行の科学雑誌「ACS Nano」のオンライン版で公開され、supplementary coverに採択された。
研究の背景と経緯
タンパク質、RNAなどの生体高分子は、細胞内で相互作用を通じて直径数マイクロメートルのマイクロ構造体である液滴(髪の毛の太さの10分の1程度の大きさ)を形成する。この現象は液–液相分離として知られ、近年、細胞生物学でさかんに研究されている。主に、ストレスなどへの刺激応答性、化学反応の制御、細胞小器官の形成などに関与することが判明しており、液滴の性質変化が病気の原因につながることも示唆されている。この液–液相分離の研究は合成生物学の分野に波及し、DNAやRNAの柔軟な配列設計を通じて任意の微小構造と機能をプログラマブルに形成するDNA/RNAナノテクノロジーに立脚して、人工的な相分離液滴を構築し高機能化させる研究が、本研究グループをはじめ国内外で行われている。
水分子が集まって液体を構成するように、DNAやRNAからなる直径数ナノメートルのナノ構造体(髪の毛の太さの1万分の1程度の大きさ)も、自発的に集合し高い流動性を持つ液滴(マイクロ構造体)を形成することができる。ユニットとなるナノ構造体はモチーフと呼ばれ、アルファベットのXやYのような分岐構造を持ち、末端同士で相互作用する。また、塩基対形成ルール(注4参照)にしたがい、モチーフ同士の相互作用を自在にプログラムすることも可能である。これにより液滴同士を自在に融合、分離させることができる(参考文献1)。近年では、特定のmiRNAの組み合わせで入力されたときだけ、水と油のようにDNA液滴がDNAの種類ごとに相分離する挙動をすることでAND演算を実行する液滴が報告されていた(参考文献2)。
DNA液滴の機能化を目指す研究が展開される一方で、もう一つのプログラマブルな生体分子であるRNAに関しては、機能性を持たない液滴の形成が報告されているのみであった。DNAに比べるとRNAは、機能および構造がはるかに多様であり、DNAより複雑な相互作用をすることが知られている。たとえば、末端にヘアピン状のループ構造を持つRNA同士が結合するキッシング・ループ(kissing loop、“KL”)相互作用は、遺伝子発現制御などに関わっている。昨今のパンデミックの際に多くの命を救ったワクチンで採用されたメッセンジャーRNAは、タンパク質の情報がコードされたDNAに似た分子である。他にも特定の分子に対して酵素機能を持つRNAなど RNAは様々な種類が存在し、それぞれ多様な機能を持つことが知られている。これらのRNAの機能を活かした、多様な機能・構造を発現するRNA液滴の実現は、プログラマブルで高機能な液–液相分離液滴の発展に不可欠な一歩である。
研究成果
今回、「がんのバイオマーカーとして知られる特定のmiRNAの入力に対してRNA液滴がAND演算を実行する」ことをコンセプトとして、「特定のmiRNAが2種類入力されたときだけ、RNA液滴が溶解する」という挙動の実現を目指した(図1a)。モチーフ間の相互作用として、ヘアピン・ループ同士のKL相互作用をRNA液滴の形成原理とした。
①AND演算RNAモチーフのデザインと働き
AND演算RNAモチーフ(図1b)は、KLを含むXs1–Xs4の配列の他に、サイドに2つの突起構造STH1とSTH2を持っている。先端に2種類のmiRNA(それぞれ“m1”および“m2”とする)の同色部分と結合する配列がある。例えば、m1が入力された場合、赤の部分はSTH1の赤色の配列と結合する。これを足がかりとして、m1の緑の部分はSTH1の緑の配列と結合し、もともとSTH1と結合していたXs4の緑の配列は切り離される(図1b)。この鎖置換反応(注6)がSTH2でも起こる結果、モチーフは2つに分離する。初期状態ではモチーフの中にKLが4個あるが、反応の結果得られるサブ構造にはKLが2個しかない。図1cに示すように、複数モチーフが結合した初期構造はネットワーク状の構造であるが、反応後はくさり状の構造へと変化する。初期のネットワーク状の構造は水に溶けにくく液滴として存在できるが、くさり状構造は水に溶けやすいため、m1およびm2が入力されたときだけ液滴は溶解する(図1c)。
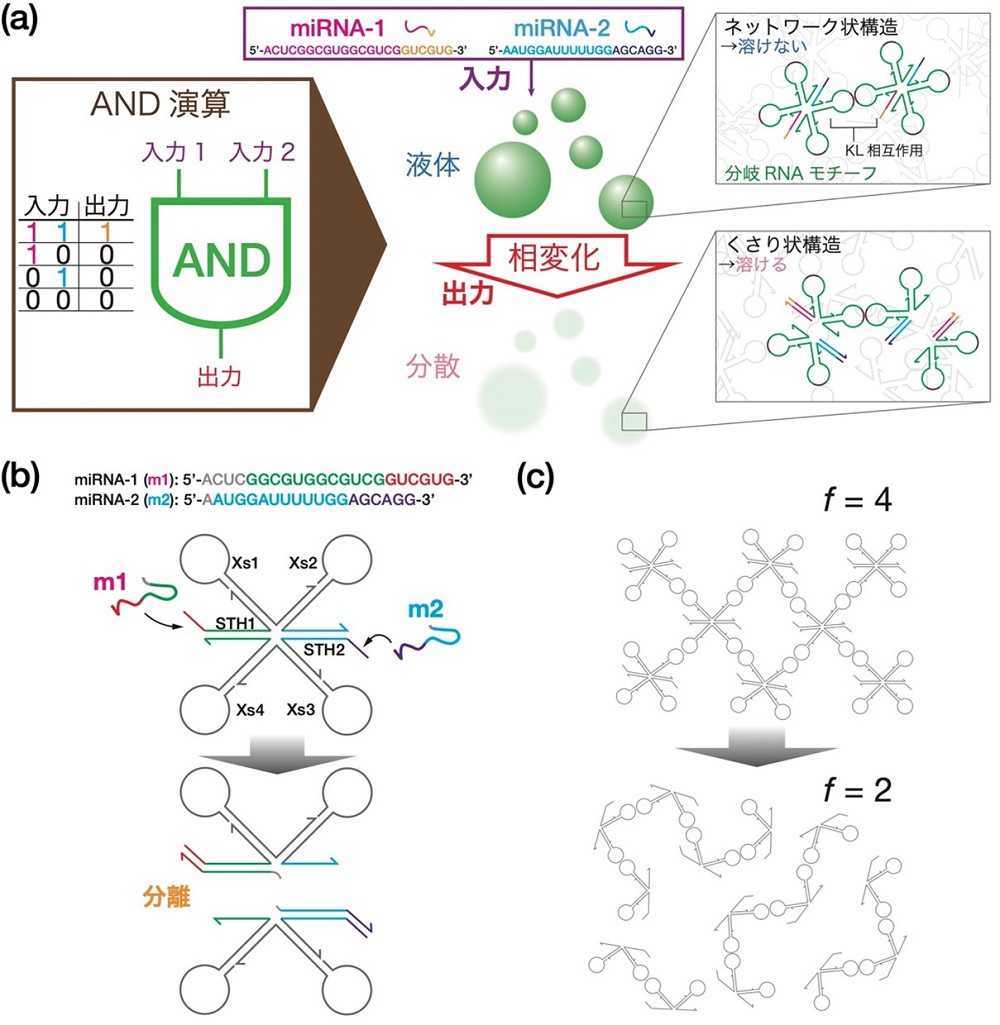
図1 入力されたmiRNAに対してAND演算を実行するRNA液滴。
(a) 入力の1と0はそれぞれのmiRNAが「ある」ときと「ない」ときを意味する。miRNA-1、miRNA-2の両方とも「ある」とき(1と1のとき)だけ出力が1になる。ここで、出力1は、「液体」である液滴が溶解する挙動として現れる。RNA液滴の構成単位は分岐状のRNAナノ構造体(モチーフ)である。分岐の先端はヘアピン状になっていて、キッシング・ループ(KL)相互作用を介してモチーフ同士が結合し、ネットワーク状の構造体を持ち、水に溶けにくい。入力が両方とも1のとき、モチーフは2つに分裂する。このサブ構造は水に溶けやすく、液滴は溶解する。 (b) モチーフの分離メカニズム。miRNAが2種類入力(1と1)されたとき、モチーフが分離する。KL相互作用を行うのは、分岐末端に位置するXs1–Xs4の配列であり、サイドにある2本の突起端STH1、2には、miRNA配列中の同色部分と結合する配列がある。各miRNAは、これを足がかりとしてSTH1、2に結合し、もともと結合していたもう一方のRNA鎖を切り離す。この鎖置換反応がモチーフの2箇所で起こる結果、モチーフは2つのサブ構造に分離する。 (c) モチーフの結合の様子。初期状態ではKLの個数が4個あるが(f=4)、鎖置換反応の結果、一つの構造にあるKLは2個に減る(f=2)。初期状態では全体がネットワーク状の構造であるが、反応後はくさり状の構造になる。
②RNA液滴によるAND演算の実証
実際にAND演算RNAモチーフから液滴を作製して、さまざまなmiRNAの入力に対する演算を実行した。今回は乳がんのバイオマーカーである4種類のmiRNA(m1, m2,m3,m4)を用いた。まず、m1およびm2に対するAND演算を実行した(図2)。入力に対して選択的にRNA液滴が溶解するかを検証するため、片方だけの入力([1, 0]および[0, 1])ならびに両方とも入力しない場合([0, 0])も検討した。入力[0, 0]ではバッファーの他に、m1、m2とは別のmiRNAであるm3およびm4(図2a)を入力とした(図2b)。
まず、AND演算RNAモチーフがRNA液滴を形成することを顕微鏡観察によって明らかにした(図2d左端)。次に、各入力の組み合わせ(図2b)の結果生じるRNA液滴の様子を観察した。入力[1, 1]のとき(図2d最上段)、25分ほど経過するとほとんどの液滴は溶けて、最終的に見えなくなった。それ以外の入力では3時間半以上の観察を通じて液滴は溶解しなかった。
以上の観察結果から、研究目的とした「特定のmiRNAが2種類入力されたときだけ、RNA液滴が溶解する」という挙動は実現された。これにより、「バイオマーカーであるmiRNAを入力としたAND演算をRNA液滴が実行できる」ことが実証され、RNAに特有の相互作用でも液滴が形成でき、機能化できることも示された。
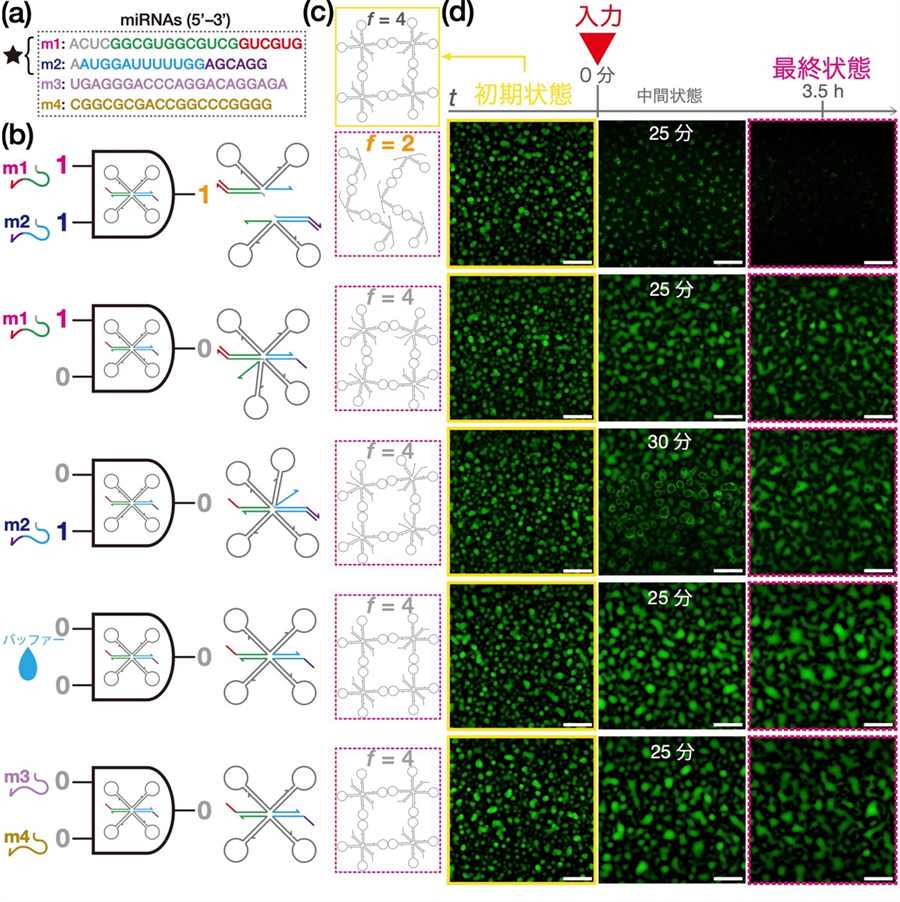
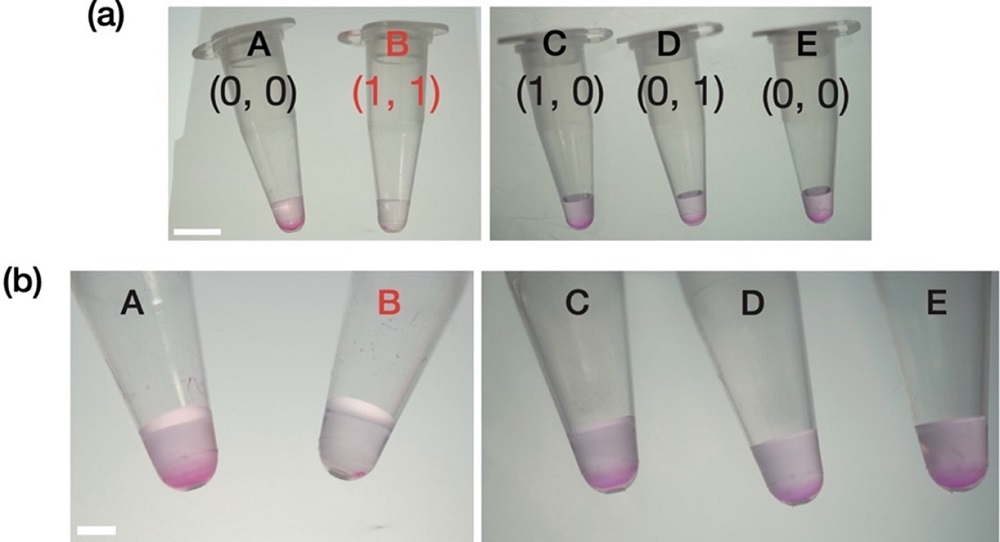
図2 RNA液滴によるAND演算の実行。
(a) 乳がんのバイオマーカーである4つのmiRNA。上の2種類が今回のAND演算でターゲットとした配列。m3、4は非ターゲット配列。(b) 入力の各組み合わせおよび対応するモチーフの最終構造。入力[1, 1]のときだけモチーフが2つに分離する。(c) モチーフの結合態様。入力[1, 1]以外はすべてネットワーク状構造が保存される。(d) 各入力に応じたRNA液滴の変化。入力[1, 1]のときだけ液滴が溶解する。スケールバーは50 µm。
③RNA液滴によるAND演算の結果を目で検出する
これまでは、蛍光分子をマーカーとして高解像度でイメージングできる共焦点顕微鏡を使って微小な液滴を観察してきた。AND演算RNA液滴のより幅広い応用を可能にするには、高価な材料や機器に依存しない検出手法が必要となる。そこで本研究ではさらに、RNA液滴の演算結果をもっと簡便かつ安価に検出する手法を開発することにした(図3)。
先ほどと同じようにRNA液滴に各入力を与えた後、メチルグリーン・ピロニンと呼ばれる細胞染色液を加えた(図3a)。これは、小中学校の自由研究などでも使われるような安価な染色液で、RNAとDNAを異なる色で染めることができる。染色液を加えたサンプルを遠心分離機で遠心させて、上澄み部分だけを新しいバッファーと交換した。m1およびm2を両方とも加えた場合、RNA液滴が溶解してなくなるため染色が見られなかった。それ以外の入力の場合、液滴は残っているため染色されたRNAの沈殿物が直接目視できた(図3b)。このように、RNA液滴によるAND演算の出力結果を高価な機器や試薬に頼らないで検出することに成功した。
社会的インパクト
本研究成果をもとに、バイオマーカーであるmiRNAを検出するがん早期診断技術への活用が見込まれる。ターゲットに応じた配列設計が可能であるため、今回用いた乳がんのバイオマーカーmiRNA以外にも多種多様なRNAの検出も可能で、柔軟かつ汎用的な応用が期待される。また、今回はAND演算という最もシンプルな論理演算のみを扱ったが、複数の論理演算を組み合わせたより高度な論理回路を組み込んだRNA液滴コンピュータへの展開が可能である。また、液滴の演算結果を直接目視で検出できる技術は、大掛かりな診断機器へのアクセスが限定されている僻地や発展途上国などでの病気、ウィルス感染診断の拡充につながる。
今後の展開
今後の基礎研究の観点からは、インテリジェントなRNA液滴ロボットを生体、生細胞、人工細胞といった環境中で転写によって発現させる技術への貢献が期待される。昨今のパンデミックで多くの人命を救ったメッセンジャーRNAワクチンにそのコンセプトの片鱗が見られる。メッセンジャーRNAワクチンは、新型コロナウィルスのスパイクタンパク質が抗体の認識部位となることを利用して、病原性のない当該タンパク質だけをコードしたRNAを体内に注入する。そして、発現したタンパク質が異物として認識されて、抗体がこれを撃退するように学習する。すなわち、特定のタンパク質をコードした情報をユーザーに送り届けるだけで、注入された細胞の中で生来的に備わっている生物学的な機構を利用して必要なパーツや機能が組み立てられていく。このように、情報工学的なアプローチから生体分子を使って高度な情報処理システムすなわち化学的人工知能を構築する研究は今後ますます活発になることが予想される。本研究では合成されたRNAから直接液滴を作製したが、将来的には液滴を構成するモチーフの配列をコードしたDNAを鋳型として細胞に注入し、細胞の転写機構を利用してRNA液滴を発現する技術への重要な足がかりが得られたといえる。
謝辞
本研究成果は、MEXT/JSPS科学研究費助成事業(JP20H00619、JP20H05935、JP24H00070、JP20H05701、JP22K14528)、Human Frontier Science Program (HFSP; RGP0016/2022-102)、Heisei Memorial Research Grants、学術振興会特別研究員奨励費(JP22J00940)の支援のもとで得られた成果である。
参考文献
(1)「DNA液滴」の形成と制御に成功(東工大ニュース2020年6月12日)
(2)液滴の分裂によって、がんの可能性の有無を示す「DNA液滴コンピュータ」の開発に成功(東工大ニュース2022年6月6日)
用語説明
(注1)マイクロRNA(miRNA)
遺伝子の発現を抑制する作用を持つ21–25塩基程度の一本鎖RNAのこと。近年の研究により、がんのバイオマーカーとしての可能性が示されている。DNAが遺伝子の書き込まれた設計図であるのに対して、RNAはタンパク質を実際に合成する際の指示書としての役割を持つ他に、遺伝子の発現の制御や細胞間の情報伝達などさまざまな機能を担っている。
(注2)AND演算
論理演算の一種。 “0”および“1”の2値(ビット)をもとにしたAND論理演算では、2入力どちらも“1”のとき出力が“1”となり、少なくともどちらかが“0”のとき出力が“0”となる。論理積ともいう。
(注3)液–液相分離
水溶液中で、混和しやすい高分子同士が相互作用を通じて集合し、混和しにくい高分子同士が排斥し合うことで、流動性を持つ液体状の構造が分離すること。
(注4)プログラマブルな生体分子
核酸(DNA、RNA)を構成する塩基のペアリングを決める「塩基対形成ルール」を利用することで、核酸構造体の形状・機能・挙動を自在に構築することができる。このペアリングは、DNAの場合、アデニン(A)はチミン(T)と、グアニン(G)はシトシン(C)と塩基対を形成する。RNAの場合、Tがウラシル(U)に置き換わる上に、GとUも緩く塩基対を形成することが知られている。
(注5)転写
DNAの塩基配列を鋳型としてRNAポリメラーゼという酵素によりDNAと同じ配列を持つRNAが合成される。ただし、TはUに置き換えられる。このRNAはメッセンジャーRNAと呼ばれ、タンパク質合成の指示書となる。
(注6)鎖置換反応
二本鎖RNAを使って説明する。片方の配列が、T-Mというドメインで表されるとする。もう一方のRNAがMと相補的なm*とすると、Mおよびm*の部分で二本鎖M/m*を形成している。ここに最初のT-M配列に相補的な3本目のRNA、すなわちt*-m*が来るとする。Tとt*が相補的であるため1本目と結合する(T/t*)。この結合を足がかりとして、m*はMと結合して(T-M/t*-m*)、もともとMと結合していたm*を切り離す。この反応はDNAでも起こる。
論文情報
著者: Hirotake Udono, Minzhi Fan, Yoko Saito, Hirohisa Ohno, Shin-ichiro M. Nomura, Yoshihiro Shimizu, Hirohide Saito, Masahiro Takinoue(鵜殿寛岳、范敏之、齊藤洋子、大野博久、野村M.慎一郎、清水義宏、齊藤博英、瀧ノ上正浩)
掲載誌: ACS Nano
DOI: 10.1021/acsnano.3c12161