指向性結合が生み出す神経ネットワークの複雑性
- マイクロ流体デバイスを用いた生体機能の再現と数理モデルの構築 -
2025/01/06
発表のポイント
- 神経細胞をマイクロ流体デバイス(注1)上で培養し、回路のつながり方に「向き」を与えることで、生物脳に近い複雑な活動パターンの再現に成功しました。
- 実験データを基にした数理モデルを構築し、神経回路のつながり方が活動に与える影響を予測可能にしました。
- 神経科学の基礎研究に加えて、医療や工学などでの広範な応用が期待されます。
概要
自然科学の基礎研究は、実験と理論が協力し合いながら発展してきました。例えばニュートン力学では、実験で観測された物体の動きを説明するように、理論や法則が作られ、さらにその正しさを検証するための実験が行われました。同様に、脳神経科学も、生物実験と数理モデルの研究が協調することで、脳の機能やその原理に関する知見をもたらしてきました。しかし、生物の脳は非常に複雑なため、神経細胞ネットワーク(注2)に関する数理モデルを生物実験に持ち込んで検証することは、一般的には困難でした。
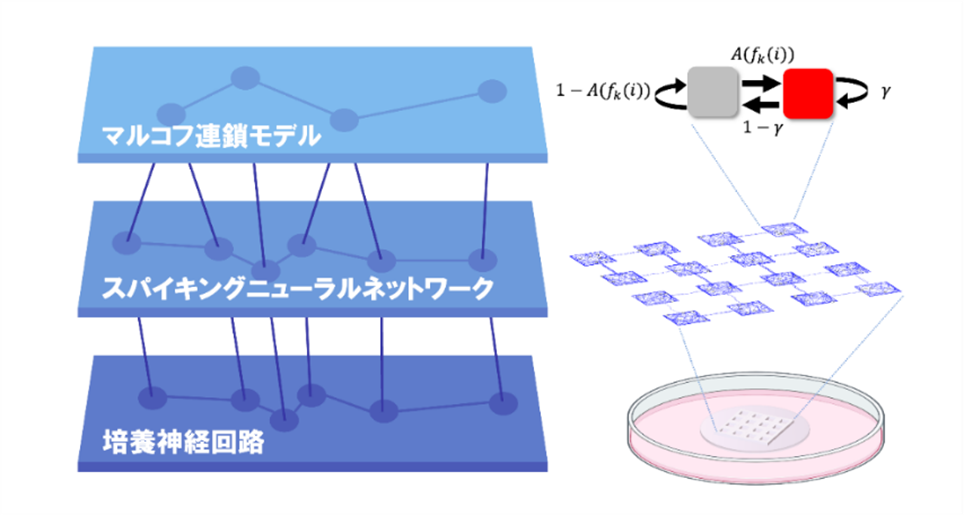
東北大学電気通信研究所の門間信明大学院生(大学院工学研究科)、山本英明准教授、佐藤茂雄教授らと大学院情報科学研究科の藤原直哉准教授の研究チームは、マイクロ流体デバイスを用いることで、神経細胞の配置やつながり方が人工的に制御された神経ネットワークを実験系で実現しました。そして、スパイキングニューラルネットワーク(注3)を使ってこの実験に対応する数理モデルを作成し、神経回路のつながり方が活動の複雑さに与える影響を予測できるようにしました。その結果、生物の脳でも見られるような複雑な発火パターンを形成する上で、神経細胞同士のつながり方が「向き」を持ち、信号が特定の方向に伝わりやすくなることが重要な因子であることを突き止めました(図1)。
本成果は2025年1月4日に科学誌Neural Networks に掲載されました。
研究の背景
神経細胞ネットワークのつながり方とそこから生み出される活動パターンの関係、いわゆる構造機能相関を解明することは、脳の働きを支える仕組みに迫るうえで鍵を握る課題です。しかし、生物の脳では神経細胞同士が極めて複雑につながっているため、この関係を直接観察して調べることは困難でした。また、このような脳の複雑さは、神経細胞ネットワークを数理モデルで取り扱う研究の発展を阻む要因となっていました。
最近、マイクロ流体デバイスなどを使って、神経細胞のつながり方を人工的にコントロールし、その影響を調べる手法が開発されました。こうした技術の進歩により、さまざまなつながり方を持つ神経細胞ネットワークを生きた細胞で作れるようになりつつあります。例えば、生物の脳で見られるモジュール構造(注4)を再現したり(参考文献1)、神経突起の伸びる方向を制御することで特定の向きを持ったつながり方(指向性結合)を再現したりすることが可能になってきました。しかし、どのようなつながり方をしたネットワークを作れば、生物の脳でも見られるような複雑な活動パターンが作り出せるのかを調べる実験手法とそれに対応させる数理モデルは、まだ十分に整備されていませんでした。
今回の取り組み
本研究チームは、マイクロ流体デバイスを構成する微小なチャネル部分の形状を非対称にすることで、モジュール構造を持った神経細胞ネットワークに指向性結合を埋め込みました。そして、カルシウムイメージング法を使って自発的な神経活動を計測し、指向性結合をフィードフォワード型に組み込んだネットワークでは、指向性結合がないネットワークと比べて、より複雑な活動パターンが現れることを明らかにしました(図2a)。
さらに本研究では、生物実験の結果を説明する2種類のモデルを構築しました。1つ目は、生物に近い振る舞いをするスパイキングニューラルネットワークモデルです。数値シミュレーションの結果、モジュール性と指向性を同時に制御することが活動パターンを複雑化させる重要な要素であることが明らかになりました(図2b)。2つ目は、「マルコフ連鎖モデル」(注5)と呼ばれる抽象化されたモデルです。このモデルにより、神経細胞ネットワークの特定のつながり方が活動の複雑性に及ぼす影響を数学的に予測することが可能となりました。この数理モデルを用いることで、ネットワーク構造と活動パターンの関係を体系的に解析することが可能になりました(図2c)。
今後の展開
この研究成果は、神経細胞ネットワークの基礎的な理解を深めるのと同時に、動物実験代替や人工ニューラルネットワークの実細胞モデルとして医療や工学の分野に応用されることが期待されます。さらに、本研究で構築した数理モデルは、生物実験の効率を高めるだけでなく、規模の大きなネットワークに対応できるよう改良することで、脳のコネクトーム解析(注6)などにも役立つ可能性があります。
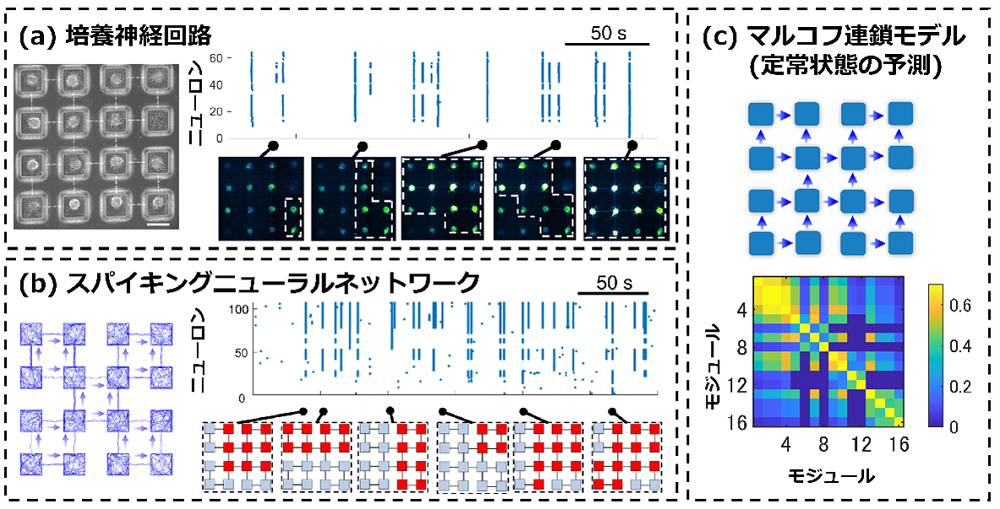
図2. 指向性結合を有するモジュール構造型神経細胞ネットワーク。(a)マイクロ流体デバイス上で培養したラット大脳皮質神経細胞による実現。左:顕微鏡写真(スケールバーは100 µm)。右:神経細胞の活動タイミングを示すラスタープロット。モジュール間に指向性結合を導入することによって、自発活動が複雑化する。(b)スパイキングニューラルネットワークによるシミュレーション。左:ネットワークの結合構造。右:神経細胞の活動タイミングを示すラスタープロット。実験で観測されたように複雑な活動パターンが発現している。(c)マルコフ連鎖モデルによる解析。上:仮定した結合方向。下:数学的に予測された、定常状態における相関係数行列。
参考文献
東北大学2024年12月12日付プレスリリース
『マイクロ流体デバイスで哺乳類の大脳皮質を模倣した神経回路の再現に成功 ~脳機能を解明するツールへの応用に期待~』
謝辞
本研究の一部は、科研費・学術変革領域研究(A)「脳神経マルチセルラバイオ計算の理解とバイオ超越への挑戦(略称:バイオ超越)」(JP24H02330、 JP24H02332)、 科研費・学術変革領域研究(B)「脳神経マルチセルラバイオコンピューティング(略称:多細胞バイオ計算)」(JP21H05164)、科研費(JP22H03657、JP22K19821、JP22KK0177、JP23H00251、JP23H02805、JP23K24913、JP23K28179、JP23K11259、JP23K16958)、JST-CREST(JPMJCR19K3)、JSTムーンショット型研究開発事業 (JPMJMS2021)、東北大学人工知能エレクトロニクス卓越大学院プログラム、東北大学電気通信研究所共同プロジェクト研究の下で行われました。本論文は「東北大学2024年度オープンアクセス推進のためのAPC支援事業」によりOpen Accessとなっています。
用語説明
(注1)マイクロ流体デバイス
マイクロスケールの3次元形状を持つ、微細加工が施されたデバイス。
(注2)神経細胞ネットワーク
脳を構成する神経細胞が神経突起を伸ばし他の細胞とつながることで形成される回路網。神経突起は軸索と樹状突起に分類され、それぞれが出力素子と入力素子を担っている。
(注3)スパイキングニューラルネットワーク
神経細胞が発生させるスパイク信号をシミュレーションすることができる生物学的妥当性が高いモデル。
(注4)モジュール構造
密に結合しあった集団が疎につながっているネットワーク構造。
(注5)マルコフ連鎖モデル
システムが複数の状態を持ち、現在の状態によって次にどの状態に変化するかが確率的に決まるモデル。
(注6)コネクトーム解析
脳を構成する神経回路における神経細胞同士のつながり方の全情報の解析。
論文情報
著者: Nobuaki Monma, Hideaki Yamamoto*, Naoya Fujiwara, Hakuba Murota, Satoshi Moriya, Ayumi Hirano-Iwata, and Shigeo Sato
*責任著者:東北大学電気通信研究所 准教授 山本英明
掲載誌: Neural Networks
DOI: 10.1016/j.neunet.2024.106967
お問合せ先
東北大学 電気通信研究所 准教授 山本 英明
(兼)東北大学材料科学高等研究所 (WPI-AIMR)
(兼)東北大学大学院工学研究科
TEL:022-217-6102
E-mail:hideaki.yamamoto.e3@tohoku.ac.jp