脱細胞化血管の微細構造が細胞機能を誘導することを発見
- ヒトiPS細胞由来の血管内皮細胞による人工血管再生のための設計指針を提示 -
2025/09/04
研究室ウェブサイト
発表のポイント
- ヒトiPS細胞由来の血管内皮細胞(hiPSC-ECs)が、脱細胞化したブタ大動脈の内腔表面に接着し、血管の長軸方向に沿って整列することを確認しました。
- 脱細胞化処理後も血管内腔に残る生体由来の微細な表面形状(溝や凹凸)が、内皮細胞の接着性や配向、さらには機能が活性化に寄与していることが明らかになりました。
- これらの成果は、生体の微細構造を活かした新たな人工血管や再生医療材料の設計戦略を提示するものであり、臓器ドナー不足や小児患者の再手術といった医療課題の解決に貢献することが期待されます。
概要
東京科学大学(Science Tokyo)総合研究院 生体材料工学研究所の岸田晶夫プロジェクト教授らの研究チームは、ブタなどの動物から採取した血管に「脱細胞化処理」と呼ばれる方法を施し、細胞成分を除去して細胞の足場(細胞外マトリクス(注1))のみを残した脱細胞化血管(注2)を作製しました。
この脱細胞化血管に、ヒトiPS細胞から作製した血管内面を覆う細胞(内皮細胞)を植え付けることで、実験室内で機能する人工血管の開発を目指しています。この技術により、体内で自ら成長・修復できる「自己成長型の血管移植片」の実現が期待されます。
本研究では、ヒトiPS細胞から誘導した内皮細胞を用い、ブタの脱細胞化血管に対する細胞の挙動を評価しました。その結果、高静水圧(High hydrostatic pressure; HHP)法[参考文献1]と呼ばれる高圧処理によって作製された脱細胞化血管では、血管内面の表面形状が良好に維持されており、この形状が内皮細胞の接着や配列、さらに血管機能に関わる遺伝子(EphrinB2など)の活性化を促進することが明らかとなりました。
この成果は、単に細胞を除去した血管組織の再生にとどまらず、血管内面の微細な構造を活かした新しい人工血管設計につながる可能性を示しています。さらに、この内面形状を活用することで、未成熟なiPS細胞の性質や機能を自在にコントロールする技術へと発展することも期待されます。
これらの技術は、より高機能かつ安全性の高い人工血管の実現に貢献するとともに、将来的には多様な再生医療への応用が期待されます。
本研究成果は、9月3日(英国時間)に「Scientific Reports」誌に掲載されました。
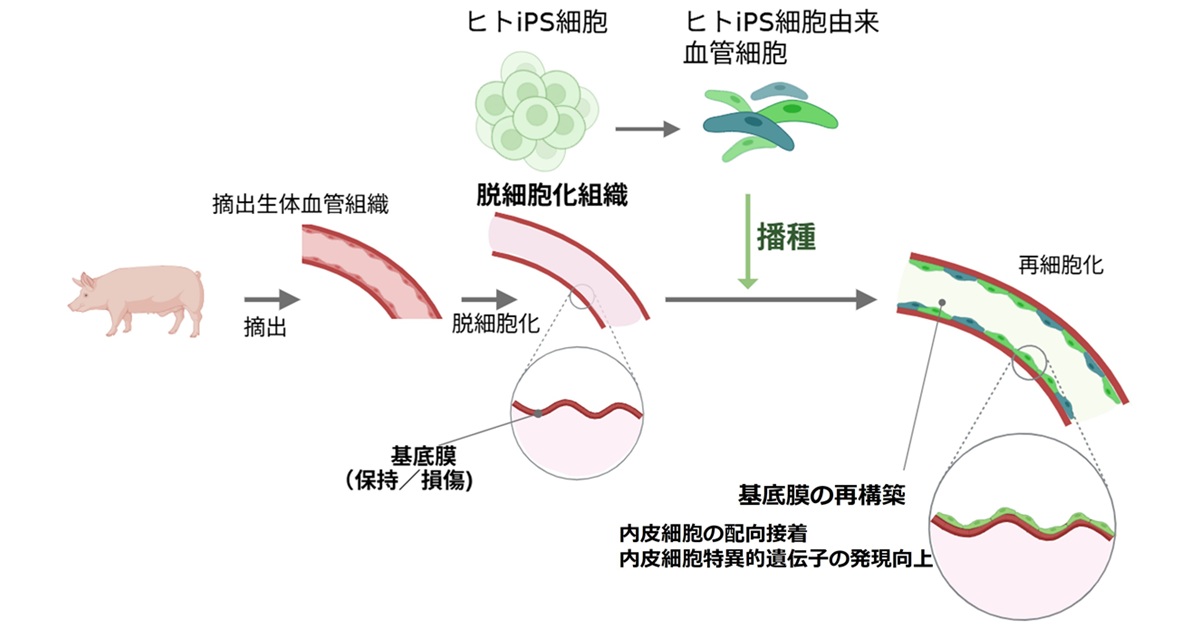
図1. 本研究成果の概要。ブタから取り出した血管組織を脱細胞化し、ヒトiPS細胞由来の血管内皮細胞を播種することにより、再生血管の構築を目指した。特に、脱細胞化後に残る基底膜の状態が、細胞の接着や機能に重要であることを示した。
研究の背景
心筋梗塞や動脈瘤などの心血管疾患は、依然として日本を含む世界中で主要な死因の一つであり、今後は高齢化の進行と伴い、患者数のさらなる増加が見込まれています。こうした疾患の治療として、人工血管や人工弁の移植が広く行われていますが、現在主流となっている合成ポリマー製の人工材料は、長期的な使用に適している一方で、生体との一体化や組織の再生といった点に課題が残されています。
特に小児や若年患者では、体の成長に伴って再置換手術が必要となる場合が多く、患者への負担が大きいことが問題とされています。そのため、成長に応じて自然に適応し、生体組織と統合される次世代型人工血管の開発が強く求められています。
その有望なアプローチの一つが、動物由来の組織から細胞成分を除去し、生体組織の構造を活かした足場(スキャフォールド)として利用する「脱細胞化組織」を用いた再生医療です[参考文献2]。この足場に患者自身の細胞や再生医療用の細胞を播種することで、機能的な組織の再構築が可能となります。
また近年では、患者由来のヒトiPS細胞から内皮細胞(hiPSC-ECs)を誘導し、脱細胞化組織に播種することで組織を再構築する方法が検討されています。iPS細胞は、患者ごとに適合した細胞の供給が可能であることに加え、倫理的・供給面でも優れた利点を有しています。
しかし、これらのヒトiPS細胞由来内皮細胞の接着や配向、機能発現に適した足場設計がどのようなものであるかについては、十分に検証されていません。そこで本研究では、異なる方法で処理された脱細胞化血管を用いて、ヒトiPS細胞由来内皮細胞の挙動を比較・評価し、機能的な人工血管を構築するための最適な足場設計の手がかりを探りました。
今回の取り組み
本研究では、ブタの大動脈を用いて、2種類の異なる脱細胞化処理を比較しました。一つは高静水圧(HHP)法、もう一つは界面活性剤の一種であるSDS法です。これらの方法によって細胞を除去した血管を足場として、ヒトiPS細胞由来の血管内皮細胞(hiPSC-ECs)が示す挙動(細胞接着、配向性、機能)を評価しました。
使用したhiPSC-ECsは、京都大学の升本英利教授らが開発した技術により、高純度かつ効率的に作製されたものです[参考文献3]。その結果、HHP法で処理した血管では、基底膜の主要な構成成分であるType IVコラーゲンと呼ばれるタンパク質が良好に保持されており、hiPSC-ECsが血管の長軸方向に沿って配向することが確認されました。さらに、動脈特有のマーカーの一つであるEphrinB2の遺伝子発現も増加し、機能的な血管内皮の再生に有利であることが示されました。
一方、SDS法で処理した血管では、強力な脱細胞化効果により細胞残存はほぼ除去されていたものの、基底膜の形状や構成成分が変化しており、hiPSC-ECsの接着や配列は確認されませんでした。
これらの結果から、脱細胞化の方法によって血管の微細構造や細胞の応答が異なることが明らかとなり、それぞれの方法におけるメリットと課題が示されました。特に、脱細胞化処理後も血管内腔の生体由来の微細な表面形状(溝や凹凸)が維持されていることで、内皮細胞の接着性や機能が高まり、生体内血管構造の再現に寄与する可能性が示唆されました。
社会的インパクト
本研究により、脱細胞化血管の内腔表面に残された凹凸形状が、ヒトiPS細胞由来の血管内皮細胞の接着や機能において重要な役割を果たすことが明らかになりました。特に、血管内皮細胞が血管内面に沿って配列し、適切に機能を発揮するためには、生体血管が本来持つ微細な形状を可能な限り保持することが重要であることが示されました。
この発見は、血管の微細形状を積極的に活用した次世代人工血管や移植用組織の設計につながる重要な知見です。今後は、より高い機能性と安全性を兼ね備えた再生医療製品の開発が加速されるとともに、心血管疾患の治療のみならず、他の再生医療分野への応用も期待されます。
今後の展開
今後の研究ではまず、ヒトiPS細胞由来の血管内皮細胞によって、より長期にわたり安定して機能する内皮層の構築を目指します。さらに、血管を構成する他の細胞(平滑筋細胞や線維芽細胞など)との組み合わせにより、生体に近い多層構造の再現にも取り組む予定です。
また、血管内腔の微細な表面形状を活用し、未分化なiPS細胞や前駆細胞の分化や機能を制御できる、新たな材料設計や細胞誘導技術の開発も検討していきます。
謝辞
本研究は、主に以下の研究助成の支援を受けて実施されました。
- 日本学術振興会 科学研究費助成事業(23K17207、24H00787、21H04954、22K08956、17H04291)
- 令和5年度 東北大学 学際科学フロンティア研究所 領域創成研究プログラム研究助成
- 東北大学2025年度オープンアクセス推進のためのAPC支援事業
参考文献
- [1] Kobayashi M et al., In vitro evaluation of surface biological properties of decellularized aorta for cardiovascular use. J. Mater. Chem. B, 2020;8.
- [2] Suzuki M et al., Application of decellularized tissue for soft-hard interregional regeneration. Front. Bioeng. Biotechnol. 2025;13.
- [3] Ikuno T et al., Efficient and robust differentiation of endothelial cells from human induced pluripotent stem cells via lineage control with VEGF and cyclic AMP. PLOS ONE. 2017;12.
用語説明
(注1)細胞外マトリクス(ECM ; Extracellular matrix)
コラーゲンなどの生体組織の細胞以外の成分であり、細胞の足場としての役割のほかに、細胞の生存、分化、機能維持にも重要な役割を果たす。
(注2)脱細胞化生体組織
ヒトあるいは異種動物(ブタ、ウシ、ウマなど)の生体組織・臓器から免疫源となる細胞成分を除去して得られる組織・臓器である。移植用および再生医療用の足場材料や創傷治癒促進材料として広く応用されている。
論文情報
著者: Mako Kobayashi, Kozue Murata, Masaya Yamamoto, Yoshihide Hashimoto, Tsuyoshi Kimura, Hidetoshi Masumoto, Akio Kishida
掲載誌: Scientific Reports
DOI: 10.1038/s41598-025-07458-9
