残光による生体深部温度の新規計測技術を確立 - 高度先進医療および脳機能の解明に貢献 -
2020/02/13
【発表のポイント】
- 脳内など生体深部温度を簡便かつ低侵襲で観測できる手法として,残光および輝尽発光による生体温度センシングの新手法を提案し,その要素技術を確立した
- 本研究で提案・開発された温度計測手法を発展させることで,将来的に,体温調整法における脳蘇生の確率向上や社会復帰の改善にも寄与する.
【概要】
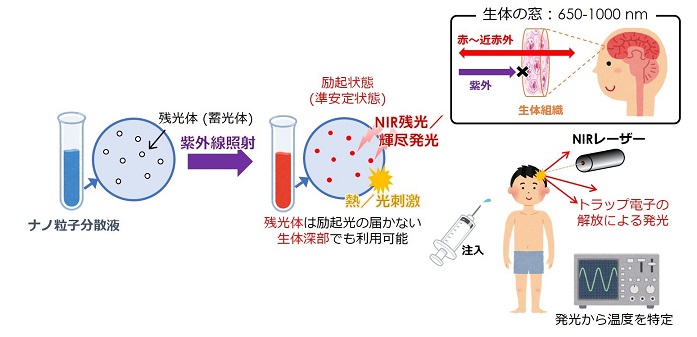
東北大学大学院工学研究科応用物理学専攻の大橋昌立氏(当時,大学院修士課程)と寺門信明助教,高橋儀宏准教授,藤原 巧教授らは,独立行政法人国立病院機構仙台医療センターの尾上紀子医師(循環器内科医長)と篠崎 毅医師(副院長)との共同研究により,低侵襲・位置選択的な生体深部温度センシングを可能とする,残光体(蓄光体)を用いた新しい光学計測技術の提案およびその基本原理の実証に成功しました.心肺停止時の脳保護に有効な体温調整法などの高度先進医療において,体温の計測や管理は極めて重要である一方,温度モニターはカテーテル挿入により行われることから,身体的負担が大きく、測定箇所が限定されるのが実情でした.本研究では,脳内など生体深部の温度を任意の位置かつ低侵襲で観測できる手法として,残光および輝尽発光現象による生体温度センシングを提案しました(図1).本研究を発展させることで生体深部における時間的・空間的温度計測が可能となり,これは高度先進医療のみならず,思考・感情といった脳内における複雑な生体反応の観察や解明にも資するものと期待されます.
本研究成果は,英国オンライン科学誌「Scientific Reports」に令和2年2月10日に掲載されました.
【詳細な説明】
研究の背景
体温は重要なバイタルサインのひとつであり,生体リズムや免疫機能など,人間の生理機能と深く関係しています.また,心肺停止後,生還時の脳機能障害のリスクを低減できる体温調整法※において,人体の深部の温度を簡便かつ正確に把握することはきわめて重要です.一般に体温を測定する方法には温度計やサーモグラフィーなどがありますが,これらは体表の温度しか測定できません.生体深部となると,カテーテルにより温度探針を血管や食道などへ直接挿入する必要があり,どうしても患者へ身体的負担を強いることになります.また,その方法では温度の測定部位が限られるという制限があります.それゆえ,低侵襲および生体深部の位置選択的温度センシング手法の確立は,医療分野においてとても重要な課題と言えます.本学応用物理学専攻の藤原研究室では,物理的アプローチにより光や熱の高度な制御方法の探索や基盤となるデバイス・材料創製を推進しています.これらの知見を活かし,藤原研究室と仙台医療センターからなる研究グループは,残光および輝尽発光現象に基づく低侵襲な新規生体温度センシングの提案とその原理実証を進めてきました.
残光体は蓄光体とも呼ばれ,暗所でも発光が持続することから時計の文字盤や誘導標識など,身近な製品に使用されています.残光体には,光照射により励起した電子がトラップサイトに捕獲されることで光エネルギーを一時的に貯蔵することができ,トラップされた電子が熱的に徐々に解放されることで持続した発光が得られます.またトラップ電子は近赤外光でも開放することができ,この現象は輝尽発光として知られています.熱および光刺激による解放過程は,残光体の環境温度に依存し,例えば残光体周囲の温度が上昇すると,残光および輝尽発光の強度減少(減衰)が急になります.研究グループでは,ナノサイズの残光体を体内に導入し,外部からこの減衰を計測することで生体内部の温度を計測できると考えました.
研究内容の詳細
残光体を用いた生体深部温度センシングを実現するにあたり,まずは温度計測プローブとなる残光体の開発に取り組みました.身近によく利用されている残光体は,吸湿性を有することから化学的耐久性に難があり,体内に導入するプローブとして適していません.そこで研究グループでは,顕著な残光特性および不純物添加による光学特性の制御性を有し,かつ生体親和性や強度が求められる人工関節や人工歯などに用いられるジルコニア(ZrO2)をプローブの候補物質として選択しました.生体環境温度付近におけるZrO2残光体の残光強度の時間依存性を測定し,それから得られる残光寿命(τ)と環境温度(T)との関係を調査した結果,τの逆数とTの逆数に明瞭な直線関係が得られ,これから, ZrO2の残光測定によりシンプルかつ正確な生体温度計測が原理的に可能であることを実証しました(図2).
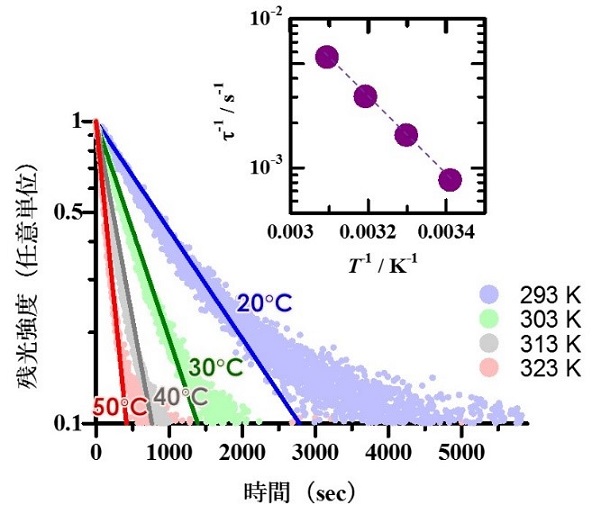
図2 残光性ジルコニアの残光減衰曲線(残光強度の時間依存性)および曲線より見積もられた残光寿命の温度依存性(インセット).インセットの図より,残光寿命の逆数(τ-1)と環境温度の逆数(T-1)には明瞭な直線関係が得られ,このことより,短時間かつ正確な生体温度評価が期待できる.
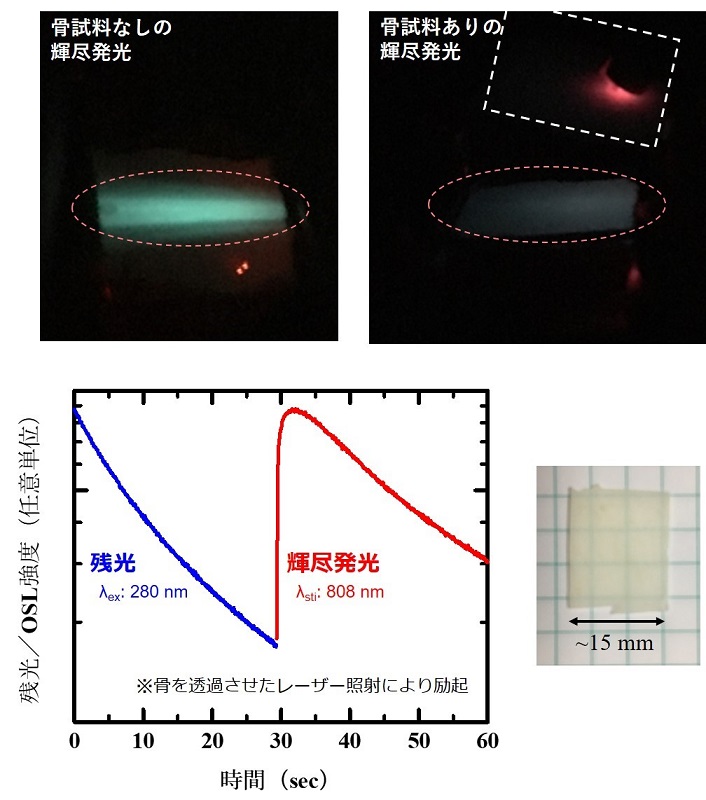
生体組織では「生体の窓」と呼ばれる波長およそ650~1000 nm(赤~近赤外領域)の高い光透過性の領域が存在します.輝尽発光の強度も温度依存性を示すことから,生体透過性および集光性が高い近赤外レーザーを人体の外部から照射することで,位置選択的かつ任意のタイミングでの温度計測が可能であると考えました.例えば,プローブとなる残光体ナノ粒子を含む液体を脳内に注入し,外部から近赤外レーザー照射することにより,低侵襲な高度生体温度センシングが期待されます(図1参照).しかしながら,脳は頭蓋骨により保護されていることから,脳内温度センシングの実現には,まずは骨を透過した近赤外レーザー光による輝尽発光を観測できるかを確認する必要があります.そこで頭蓋骨の模擬骨試料であるウシの大腿骨を準備・加工した後,近赤外レーザーの手前に模擬骨試料を配置し,ZrO2残光体へレーザー照射した結果,輝尽発光の観測に成功しました(図3).このような骨組織を透過した近赤外レーザーによる輝尽発光実験は過去に報告がなく,本結果は生体深部や脳内における温度分布計測の実現性を示すものと考えられます.
研究の意義・今後の展望
体温調整法では,心肺停止後からの生還時における脳機能障害のリスクを低減できることから,この生体深部温度センシングの新規手法の開拓の意義は大きく,また本研究を推進することで,心肺停止した患者の社会復帰やQuality of Lifeの向上へも将来的に貢献すると考えられます.さらに,ナノ残光体による生体深部計測法を発展・拡張することで,これまで複雑かつ難解であった脳や脳神経が織りなす高度な脳機能、すなわち、思考・感情をはじめとする多重的な生体反応を温度分布計測の観点から解明できるものと期待されます.
用語解説
※体温調整法
心停止後,全身を32~34ºCまで冷却することで脳代謝を減少させ,脳の細胞死を抑制する方法.
論文情報
(和訳:ジルコニアにおける残光の温依存性および生体温度プローブのための骨透過レーザー照射による輝尽発光)
著者: Masaharu Ohashi, Yoshihiro Takahashi, Nobuaki Terakado, Noriko Onoue, Tsuyoshi Shinozaki, and Takumi Fujiwara
掲載誌: Scientific Reports
DOI: 10.1038/s41598-020-58979-4
URL: https://www.nature.com/articles/s41598-020-58979-4
参考資料
タイトル: 生体温度センシングのためのZrO2の残光および輝尽発光
著者: 高橋儀宏,寺門信明,尾上紀子,篠崎 毅,藤原 巧