腸の活発な運動で促進される糖質吸収の可視化に成功
- 肥満や糖尿病、腸内細菌に関する栄養吸収メカニズムの解明に期待 -
2022/09/22
発表のポイント
- 蛍光色素で標識したグルコースを用いて腸における栄養吸収の可視化に成功
- 線虫の腸内流動と腸壁における栄養吸収を関係付ける力学法則を発見
- 腸の活性・疾患や腸内細菌に関係する栄養吸収メカニズムの解明に期待
概要
食物から栄養を得る生き物にとって、腸における食物消化と栄養吸収は重要な生命活動の一つです。腸内の流動が速く、また腸の表面積が大きい場合にはグルコース(糖質の一種、ブドウ糖)・ビタミン・ミネラルなどの栄養素の吸収が促進されますが、反対に腸内の流動物の粘度が高く流動が遅い場合にはグルコーストランスポーター注1におけるグルコースの取り込みやインスリン分泌の減少が知られています。しかし、腸内における栄養の取り込みと腸内の流動の関係は生理学的・薬理学的に重要であるにもかかわらず力学的メカニズムの詳細はこれまで明らかにされていませんでした。
東北大学大学院工学研究科の鈴木雄貴博士(研究当時、後期博士課程在籍)、菊地謙次准教授らの研究グループは、モデル生物注2である線虫(C. elegans) 注3を用いて、排便モータープログラム(DMP)注4による腸内の流動と腸壁からのグルコース吸収について、流体力学ではよく知られたTaylor分散注5によって腸内で栄養物質が撹拌され、腸壁での栄養吸収を助長していることを発見しました。この発見は、腸の活性・疾患や腸内細菌に関する肥満や糖尿病などにおける栄養吸収に関する力学的メカニズムの解明につながる成果です。
本研究成果は、2022年9月21日に、「Scientific Reports」に掲載されました。
研究の背景
脊索(せきさく)動物や脊椎動物、軟体動物や線形動物など数多くの動物は外部からエサを捕食し、腸で消化吸収することで栄養を獲得する消化器官を有しています。腸での食物消化は、周期的な筋肉の収縮と弛緩をする腸の蠕動(ぜんどう)運動によって輸送されつつ、蠕動による流れの中で物理・化学的に分解されます。その後、腸上皮において吸収され、不要物は肛門から排出されます。腸内において蠕動が活発な場合、腸内の流動が速く、また腸の表面積が大きい場合には、グルコース・ビタミン・ミネラルなどの栄養素の吸収が促進され、反対に腸内の流動物の粘度が高く、腸内の流動が遅い場合にはグルコーストランスポーターによるグルコースの取り込みやインスリン分泌が減少することが生理学的に知られています。腸内における栄養の取り込みと腸内の流動の関係は、生理的・薬理学的に重要であるにもかかわらず、腸の蠕動と腸内の流れの計測と、栄養吸収を直接観察することが困難であったため、詳細な力学的メカニズムはこれまで明らかにされていませんでした。
研究の内容
東北大学大学院工学研究科の鈴木雄貴博士(研究当時、後期博士課程在籍)、菊地謙次准教授、大学院医工学研究科の沼山恵子准教授、石川拓司教授の研究グループは、動物の消化器官の基本構造を有する線虫(C. elegans)を用いて、腸内における栄養吸収と腸の蠕動による腸内流動との関係について、これまでの生理学的な知見に流体力学的観点を併せて、腸内の流動が関与する新たな栄養吸収メカニズムを発見しました。細胞内活動の主要なエネルギー源として重要な役割を持つグルコースの吸収に着目し、動物の腸細胞上におけるグルコーストランスポーターによるグルコースの細胞内への輸送について、細胞・組織スケールの可視化計測法を構築し、腸におけるグルコース吸収の時系列計測を行いました。
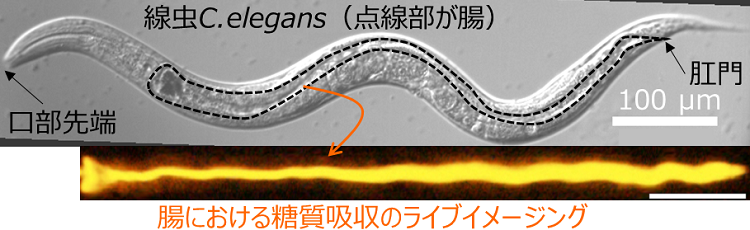
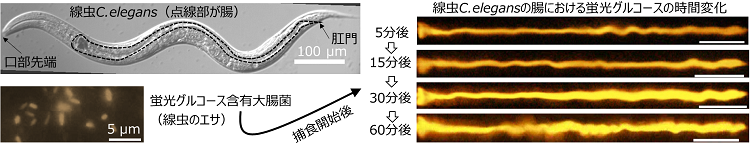
具体的には、蛍光色素で標識したグルコースを用いて大腸菌を培養し、大腸菌内に蛍光グルコースを包含させた蛍光大腸菌を作成し、その大腸菌をエサとして線虫に与えることで、腸における栄養(グルコース)吸収の可視化実験を行いました(図1)。捕食開始後、蛍光大腸菌が口部で咀嚼され、破砕された大腸菌内部の蛍光グルコースが咽頭部より腸へと輸送され、腸内において蛍光グルコースが徐々に蓄積する様子を生きたまま可視化を行うライブイメージングに成功しました。
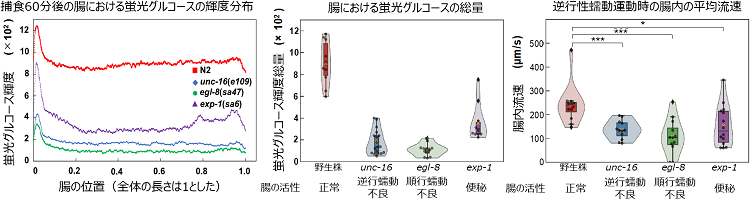
さらに、腸の活性が通常と不活性の時、また便秘の時の腸における糖質の吸収を比較するため、野生株および3種類のDMP欠損突然変異株(unc-16: aBoc欠損株, egl-8: pBoc欠損株, exp-1: E.p.欠損株)の線虫を用い、腸におけるグルコース吸収の計測と腸内における流速計測を行い、腸内の流動と腸壁からのグルコース吸収について実験的調査を行いました。エサの摂取量には株に依らず差は見られなかったものの、それぞれの変異株では野生株よりもグルコース吸収が著しく低下しており、またDMPによって生じた順行性および逆行性の蠕動運動による腸内の流速も、変異株は野生株よりも減少していました。これにより腸内の流動がグルコース吸収量に大きく寄与することが示唆されました。また、流体力学に基づく腸内のグルコースの輸送と腸壁における吸収について理論解析を行った結果、流体力学ではよく知られたTaylor分散によって腸内でグルコースが撹拌され、腸壁でのグルコース吸収を助長していることを発見しました(図2)。
今後の展望
本研究は、腸における栄養吸収や腸内環境の変化について、生理学的・薬理学的知見に加え、新たに力学的な見解に基づく栄養吸収メカニズムの可能性を示唆するものです。腸の活性・疾患、腸内細菌に関係する肥満や糖尿病などにおける栄養吸収や消化、腸内における物質代謝など未知の生理現象について、力学的知見に基づくメカニズムの解明に貢献すると考えられます。
用語説明
(注1)グルコーストランスポーター
グルコース輸送体と呼ばれる細胞外および細胞同士のグルコースの輸送を司る膜貫通型タンパク質。腸内腔から腸細胞へはナトリウム‐グルコース共輸送タンパク質によって能動的に輸送され、また細胞間においてはグルコースの濃度勾配によってグルコース輸送タンパク質を通じて受動的に輸送される。
(注2)モデル生物
生物の普遍的な基本原理や、人間自身を知るための非常に優れた実験系として利用されている生物のこと。
(注3)線虫(C. elegans)
生命科学研究において広く使われているモデル動物で、多細胞生物として初めて全ゲノム配列が解読された種。「究極のモデル生物」とも称されている。
(注4)排便モータープログラム(DMP)
Defecation Motor Programの略称であり、後体幹筋収縮(pBoc)、前体幹筋収縮(aBoc)、排出筋収縮(E.p.)の3つの異なる運動ステップによって行われる排便運動を指す。
(注5)Taylor分散
流体力学の研究者Geoffrey Ingram Taylor が1953年に提案した流体中における物質輸送であり、流れが一様ではなく流れの差が生じる場合の物質の広がる現象を指す。分散もしくは移流拡散と呼ばれている(日野幹雄、「流体力学」、朝倉書店、第18版)。
付記
本研究は、科研費(21H04999、19H02059、21H05306、21H05308)、JST創発的研究支援事業(JPMJFR2024)およびJST次世代研究者挑戦的研究プログラム(JPMJSP2114)の支援を受けて行われました。
論文情報
著者: Yuki Suzuki, Kenji Kikuchi, Keiko Numayama-Tsuruta, Takuji Ishikawa
掲載誌: Scientific Reports
DOI: 10.1038/s41598-022-18968-1
URL: https://doi.org/10.1038/s41598-022-18968-1
お問合せ先
東北大学大学院工学研究科 准教授 菊地 謙次(東北大学ディスティングイッシュトリサーチャー)
TEL:022-795-5029
E-mail:k.kikuchi@tohoku.ac.jp