失明に繋がる網膜疾患の病態を一部生体組織チップ上で再現 病態解析や創薬スクリーニングへの応用に期待
2017/06/15
【発表のポイント】
- 眼内の網膜と呼ばれる光を感知する神経組織の一番外側の構造を模倣して、チップ上でヒト由来の網膜の細胞と血管の細胞を培養しました。
- チップ上の細胞を低血糖状態や低酸素状態にすると、血管の細胞が網膜の細胞側に移動し、網膜の細胞がダメージを受けることを示しました。
- 滲出型加齢黄斑変性(注1)の主要な病態である新生血管の発生を一部再現したものであり、病態解析や創薬スクリーニングに応用できる可能性があります。
【概要】
ヒトでは感覚入力の約80%が眼からの入力であるため、失明に繋がる網膜疾患を罹患すると、患者の生活の質の著しい低下を招きます。加えて、網膜疾患は高齢者に多く、超高齢化社会を迎えた我が国では視機能障害対策が喫緊の課題となっています。網膜疾患に対する医薬品候補化合物の評価には、疾患モデル動物が使われていますが、ヒトと動物の種差があるので得られる結果の信頼性が必ずしも高いわけではなく、コスト面、倫理面においても課題を有しています。最近、創薬を目的とした生体組織チップの開発が盛んに行われていますが、肺や肝臓、腸などを対象としたものがほとんどで、眼を対象とした研究はほとんど行われていませんでした。
東北大学大学院工学研究科の梶弘和准教授らは、同医学系研究科の阿部俊明教授らと共同で、失明に繋がる網膜疾患の病態の一部をチップ上で再現することに成功しました。
まず、網膜の一番外側の構造を模倣して、チップ上でヒト由来の網膜の細胞と血管の細胞を培養しました。細胞がある程度成長した後に、網膜の細胞を低血糖状態や低酸素状態にすると、血管の細胞が網膜の細胞側に移動し、網膜の細胞がダメージを受けることがわかりました。この過程は、滲出型加齢黄斑変性の主要な病態である新生血管の発生を一部再現したものであり、疾患モデル動物の代替として病態解析や創薬スクリーニングに応用できる可能性があります。
本研究の成果は、平成29年6月14日(英国時間)付けで、Scientific Reports誌(電子版)に掲載されます。本研究は、文部科学省科学研究費助成事業の支援を受けて行われました。
【研究内容】
ヒトでは感覚入力の約80%が眼からの入力であるため、失明に繋がる慢性網膜疾患を罹患するとQuality of Life(QOL)の著しい低下を招きます。加えて、網膜疾患は高齢者に多く、超高齢化社会を迎えた我が国では網膜疾患の病態解析と治療法開発が喫緊の課題となっています。網膜疾患に対する医薬品候補化合物の評価には、疾患モデル動物が使われていますが、ヒトへの外挿性の他、倫理面、コスト面でも課題を有しています。加齢黄斑変性など新生血管の出現は失明原因の主要な病態として重要ですが、加齢、酸素濃度、エネルギー代謝、圧、血流、遺伝子など様々な因子が関わっており、その背景は複雑です。新しい薬剤や治療法の開発には、眼疾患の病態メカニズムを正確に理解することが必須であり、複雑で慢性的な病態を簡単に模擬できる培養モデルが極めて有用です。最近、創薬を目的としたヒト生体組織チップ(注2)の開発が盛んに行われていますが、現在検討されている培養モデルのほとんどが、肺、肝、腸などの消化呼吸器系を対象としており、これまで眼組織を対象とした生体組織チップ的なアプローチはほとんど検討されてきておりませんでした。
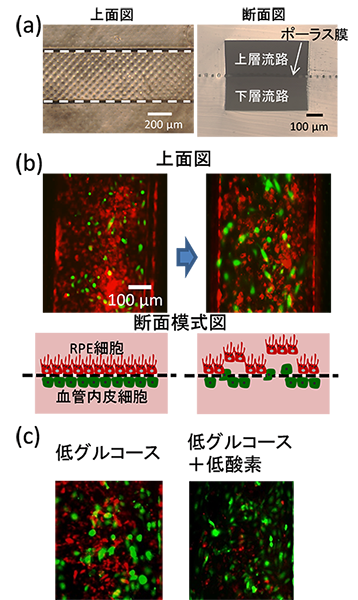
本研究では、眼底構造を模倣して、ヒト由来の網膜色素上皮(RPE)細胞(注3)と血管内皮細胞を3次元マイクロ流路デバイス内に配置・培養して、細胞周囲環境を制御下で両細胞間の相互作用を検討しました。本研究に用いた3次元マイクロ流路デバイスは、2層式のマイクロ流路から成り、各流路がポーラス膜で隔てられています(図1a)。まず、片方のマイクロ流路にRPE細胞を導入して、ポーラス膜(多孔質の膜)上で単層組織を形成させた後、もう片方のマイクロ流路に血管内皮細胞を導入して、RPE層の反対側のポーラス膜に血管内皮細胞を接着させて共培養系を作製しました(図1b)。この状態でも多少血管内皮細胞がポーラス膜を通過してRPE層側に遊走する様子が観察されましたが、RPE層側に低グルコース負荷や擬似低酸素負荷を与えると、RPE層側に遊走する血管内皮細胞の数が増加し、対応してRPE層の崩壊面積も増加しました(図1c)。RPE細胞の単培養において、低グルコース負荷や擬似低酸素負荷がRPE細胞からの血管内皮成長因子(VEGF)の分泌量を増加させることを確認しており、当共培養系における血管内皮細胞の応答はRPE細胞が分泌したVEGFによるものであると考えられます。また、低グルコース負荷や擬似低酸素負荷ではRPE層の崩壊は認められなかったので、RPE層側に遊走した血管内皮細胞がRPE層を崩壊させたと考えられます。この過程は、滲出型加齢黄斑変性の主要な病態である新生血管の発生を一部再現したものであり、疾患モデル動物の代替として病態解析や創薬スクリーニングに応用できる可能性があります。
今後の展開として、血管内皮細胞の毛細血管網化や神経網膜の追加などにより、より生体機能に近い生体組織チップの開発が考えられます。また、患者iPS由来の成熟分化細胞で各細胞を置換することで、個々の患者に合せた治療法の開発や創薬スクリーニングへの発展も見込めます。さらに、他の臓器を模倣した生体組織チップと接続することで、全身の薬物動態を検討できる可能性もあります。
【用語説明】
注1 加齢黄斑変性
網膜組織中心の黄斑に異常な老化現象が起こり、視機能が低下する難治性の網膜疾患。大きく分けると萎縮型と滲出型の2つの種類がある。萎縮型は網膜色素上皮が徐々に萎縮していき、網膜が障害され視力が徐々に低下していく。滲出型は異常な血管(脈絡膜新生血管)が脈絡膜から網膜色素上皮の下あるいは網膜と網膜色素上皮の間に侵入して網膜が障害される。欧米では成人の失明原因の1位であり、日本においては緑内障、糖尿病網膜症、網膜色素変性についで4位。社会の高齢化に伴い近年患者数が急激な増加傾向にある。
注2 生体組織チップ
生体組織・臓器の構造や機能を模倣した新しいタイプの3 次元培養モデル。微細加工技術やマイクロ流体技術を利用して、生体内に近い環境で細胞を培養する。古典的な培養細胞モデルと動物モデルの中間に位置する。
注3 網膜色素上皮(RPE)細胞
網膜の一番外側にある網膜色素上皮層を一層構造で形成する細胞。視細胞と脈絡膜の間にあり、主な機能は、血管網膜バリア、視細胞外節の貪食、栄養因子の分泌などで網膜の恒常性を維持する。
【論文題目】
Microfluidic co-cultures of retinal pigment epithelial cells and vascular endothelial cells to investigate choroidal angiogenesis (脈絡膜新生血管精査のための網膜色素上皮細胞と血管内皮細胞のマイクロフルーイディック共培養)
Li-Jiun Chen, Shuntaro Ito, Hiroyuki Kai, Kuniaki Nagamine, Nobuhiro Nagai, Matsuhiko Nishizawa, Toshiaki Abe, Hirokazu Kaji
Scientific Report