PRESS RELEASE
2005/06/08材料システム工学専攻の鈴木誠教授等の研究グループは筋肉の収縮機構におけるミオシンの一部位が新たな道の移動をすることを明らかにしました。
東北大学大学院工学研究科材料システム工学専攻の鈴木 誠 教授の研究グループは,産業技術総合研究所ジーンファンクション研究センター 副センター長上田太郎博士、東京大学医科学研究所 片山栄作教授らと共同で,筋肉収縮においてミオシンのモーター部位が相互作用するアクチンフィラメント上の接触部位が、従来から考えられてきたサブドメイン1ではなく別の新たな道を移動することを明らかにした。本研究は文部科学省特定領域研究「水と生体分子」および「アクチュエータ」プログラムの一つとして実施。
【背景】
筋肉はアクチンフィラメントとミオシンフィラメントの相対的なすべり運動で収縮が起こる。これまでミオシンのモーター部S1はアクチンのサブドメイン1に結合して力を発生し運動すると考えられてきた。世界の多くの筋肉研究はこの考えを基礎としている。
【研究内容と成果】
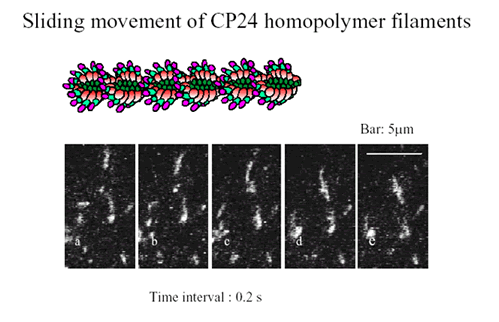
今回われわれは、細胞性粘菌を用いて、モータータンパクであるミオシンのモーター部位S1をベースとして、そのループ2とよぶフレキシブルにアクチンと結合することがわかっている配列にアクチンの全配列を挿入してキメラタンパクを作成した。このキメラタンパクのS1部は天然のS1と同程度のATP分解活性を示し、またアクチン部は重合してフィラメントを形成できる。このフィラメントをローダミンファロイジンとよぶ蛍光色素で染色すると蛍光顕微鏡によりその運動を観ることができる。またこのフィラメントをマイカレプリカ急速凍結法で電子顕微鏡観察するとライガー結合に類似の構造をしていることがわかった。すなわち、アクチンフィラメントのすべてのサブドメイン1はミオシンS1部でおおいかくされていて、外からアクセスできない状態になっている。このキメラタンパクのフィラメントは、骨格筋ミオシンをコートしたガラス板上でATP存在の下で、通常のアクチンフィラメントとほぼ同じ速度ですべり運動を示したのである。キメラタンパクのフィラメントのS1部がむかでのように動いている可能性は、骨格筋ミオシンのないBSA表面やメチルセルロース濃厚液中ですべり運動が起こらないという実験で否定された。このことはアクチンフィラメントにそってミオシンモーター部S1が移動する新たな道が存在することを示している。
【応用展開】
従来からアクチンフィラメント上で数珠つなぎにらせん状にならぶサブドメイン1がミオシンのモーター部位が移動する道と考えられてきた。しかし本研究によりそれが正しくないことが示された以上、これまで支持されてきた多くのアクトミオシン運動の分子メカニズムが根本から再構築を余儀なくされるだろう。いったいミオシンはアクチンのどこと接触して力を発生するのか、今後の新たな展開が待たれる。著者らが最近アクチンフィラメント周りに発見したハイパーモバイル水がミオシンモーター部位との結合解離で大きく増減するという新しい現象もますます重要になってくると考えられる。この機構が解明されるなら工学的にも新しいナノアクチュエータや人工筋肉に道が拓かれるかもしれない。
【成果発表】
2005年7月1日に.米国ライフサイエンスの国際論文誌Biochemical and Biophysical Research Communications, volume 332 に掲載される。
【お問合せ】
東北大学工学研究科・工学部情報広報室
TEL/ FAX:022-795-5898
E-mail:情報広報室メールアドレス