PRESS RELEASE
2005/10/28材料システム工学専攻の鈴木誠教授等の研究グループは筋収縮の分子メカニズムであるアクチンフィラメントの共同的な構造変化を始めて検出しました。
工学研究科材料システム工学専攻の鈴木誠教授等の研究グループは筋収縮の分子メカニズムであるアクチンフィラメントの共同的な構造変化を始めて検出しました。
【背景】
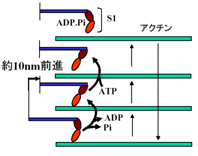
筋肉の収縮はミオシンフィラメントとアクチンフィラメントの相互の滑り運動によって起こる。現在一般に受け入れられているメカニズムは、「相互の滑り運動を引き起こす力がミオシン分子のモーター部(S1)が中央で屈曲することによって発生する。」というもの。この分子内屈曲はエネルギー源であるATPを S1が加水分解する反応に同期して起こるため、1回のATP分解反応で1回屈曲して1ストローク推定10nmを進むと想像されている。化学反応サイクル数とストローク回数が1:1で起こる考え方はタイトカップリング説と呼ばれる。それに対して大沢らのルースカップリング説があり、前後方向のランダムな熱運動を一方向に制御する仕組みを取り入れた多くのモデルが提案されている。そのどれもアクチンフィラメントの協同的構造変化による非対称ポテンシャル形成を仮定している。しかしながら、ATP存在下でミオシンが相互作用するときのアクチンフィラメント上の協同的な構造変化をとらえることはまだできていない。その第一の理由はATPがあるとアクチンとミオシンの結合が極めて弱く、相互作用を安定に維持できないためである。
【研究発表】
今回われわれは、産業技術総合研究所、東京大学医科学研究所と共同で、アクチンフィラメントが、ATPを分解するミオシンとの弱い相互作用において協同的な構造変化を示すことを初めて検出することに成功した。通常の水よりもさらさらと動きやすいハイパーモバイル水が筋収縮に大きく影響するわれわれの仮説を支持する。米生物科学雑誌「Biochemical and Biophysical Research Communications」に10月26日オンライン公開(雑誌の発行日12/2)された。
【研究内容と成果】
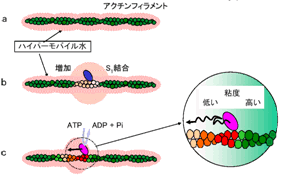
今回の実験では、ATP分解反応中も、アクチンフィラメントとミオシンS1ドメインが弱いながらも結合状態を維持できる独自の“アクトS1”キメラタンパク質を使った。骨格筋のアクチンに蛍光色素のピレンを導入し、作製したキメラタンパク質と共重合させることで、ATP分解反応によるアクチンの構造変化を検出する実験系を構築した。
その結果、アクトS1での1つのATP分解反応により、周囲の4つのアクチンが協調的に構造変化する様子が検出された。そのときハイパーモバイル水が減少する方向のシグナルを得たことから、弱い結合状態でこそアクチンが大きく構造変化し、筋収縮が制御できる効率的なシステムが浮かび上がった。
今回の実験条件は、タンパク分子間距離が生体内に極めて近い。また従来の筋収縮メカニズムの解釈では、弱い結合時のアクチンの構造変化はエネルギーの損失でしかなく、筋収縮を妨げる結果になってしまう。アクチンとミオシンとのいわゆる強い結合が筋収縮に重要ではないことを示したこと(BBRC 332, 2005)に続き、今回、弱い結合時に協同的構造変化が起こることを証明した。アクチンの周りのハイパーモバイル水の増減にもとづく筋収縮という私たちのモデルがいっそう重要性を増すことだろう。
【研究室ホームページ】
http://www.material.tohoku.ac.jp/jp/labs/mate05.html
【お問合せ】
東北大学工学研究科・工学部情報広報室
TEL/ FAX:022-795-5898
E-mail:情報広報室メールアドレス